V decembrski številki prestižne revije Nature Reviews Neurology (IF 44,71) sta Matej Perovnik in asist. Tomaž Rus skupaj z dvema ameriškima sodelavcema objavila pregledni članek, ki ugotavlja možnosti funkcijske slikovne diagnostike možganov pri opredelitvi nevrodegenerativnih bolezni (Functional brain networks in the evaluation of patients with neurodegenerative disorders).
Kako je prišlo do nastanka članka?
Članek je nastal kot plod dolgoletnega sodelovanja Kliničnega oddelka za bolezni živčevja in Klinike za nuklearno medicino UKC Ljubljana s Centrom za nevroznanost na Feinsteinovih inštitutih za medicinske raziskave v New Yorku, ki ga vodi prof. David Eidelberg. Raziskovalna skupina v New Yorku se namreč že od konca osemdesetih let prejšnjega stoletja ukvarja s funkcijskimi slikovnimi biološkimi označevalci pri nevrodegenerativnih boleznih možganov, prvi stik pa je pred več kot dvajsetimi leti navezala najina mentorica, izr. prof. dr. Maja Trošt. Od prve vzpostavitve stika do danes je tudi naša raziskovalna skupina v Ljubljani pomembno in z mnogimi izvirnimi znanstvenimi publikacijami prispevala k napredku na tem področju. Inštitut sva v letih 2021 in 2022, vsak za pol leta, obiskala tudi midva, dr. Perovnik kot mladi raziskovalec v sklopu doktorskega študija, dr. Rus pa kot Fulbrightov štipendist. Ideja za članek je izhajala iz dejstva, da se je v zadnjih letih na tem področju zgodil velik napredek, ki še ni bil primerno pokrit v preglednem članku.
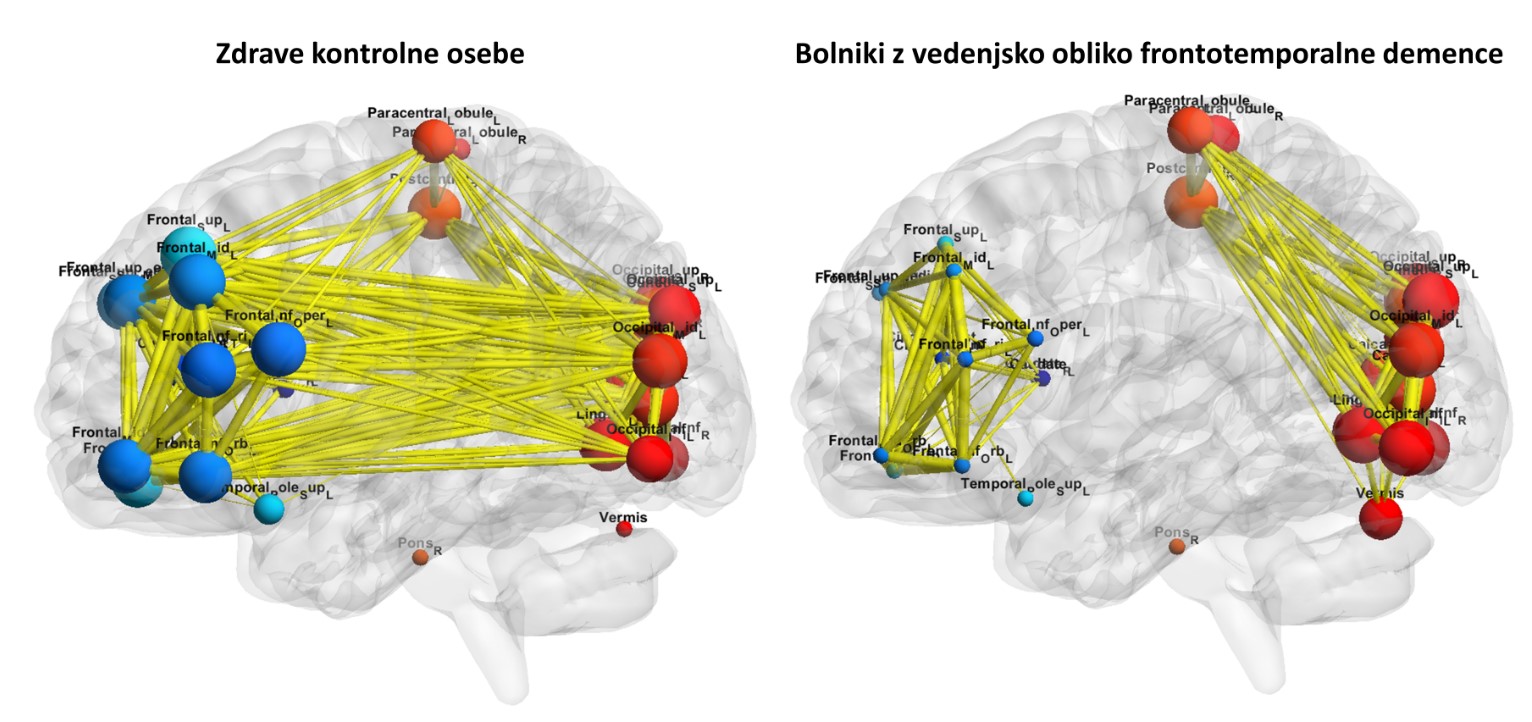
V omenjenem članku povzemamo napredek na področju funkcijske slikovne diagnostike in naprednih analitičnih pristopov v zadnjih petih letih. Te tehnike nam omogočajo, da slik možganov ne ocenjujemo le z vidnim pregledom, temveč tudi kvantitativno. Poleg tega so raziskave pokazale, da se delovanje možganov veliko bolje opiše, če nanje gledamo kot na omrežje in ne na regijsko ločene dele. Seveda pa potrebujemo pomoč naprednih analitičnih metod, da si ta omrežja prikažemo ter opredelimo njihovo aktivnost oz. izraženost pri posameznem preiskovancu. Na tej točki naj pojasniva, da z izrazom omrežje (angl. network) opišemo med seboj povezane dele možganov. Možganska omrežja so sestavljena iz različnih predelov, ki so povezani strukturno, npr. preko traktov oz. prog v beli možganovini, ali funkcijsko. Za funkcijska omrežja je značilno, da je aktivnost delov omrežja usklajena v času.
V članku uporabljate nekaj metod funkcijskega slikanja možganov: FDG PET; H2 15O PET; SPECT; dinamični PET z 18F-radiofarmaki. Poleg tega uporabljate tudi nekaj tehnik MRI-preiskav. Kaj prikazujejo posamične tehnike?
Funkcijske slikovne metode lahko v grobem razdelimo na radiološke in nuklearnomedicinske. Pri slednjih (PET in SPECT) se zanašamo na radioaktivno označene sevalce oz. radiofarmake, ki jih bolniku apliciramo intravenozno. Radiofarmaki se nato razporedijo po telesu ali vežejo na določene beljakovine, glede na svoje biološke lastnosti, ter nato oddajajo radioaktivno sevanje, ki ga zaznamo s posebno kamero. Od vrste radiofarmaka je odvisno, kaj nam slikovna metoda prikaže. Recimo pri slikanju s FDG PET je radiofarmak glukoza, označena z 18F (FDG). Poenostavljeno: telesne celice privzamejo glukozo, ker je to njihovo »gorivo«, in celice v možganih – po večini nevroni – so energetsko zelo potratne, tako da je privzem velik. Slika FDG PET tako odraža možgansko aktivnost. Ta pa je značilno spremenjena pri nevrodegenerativnih boleznih možganov, kot so parkinsonizmi in demence.
Potem so tu radiofarmaki, kot je H2 15O PET – radioaktivna voda, ki nam pokaže prekrvavitev možganov. Voda namreč ostaja v žilah. H2 15O PET se zaradi kratke razpolovne dobe izotopa kisika (2 minuti) uporablja le v raziskovalne namene, saj nam radiofarmak razpada prehitro, da bi bil primeren za nepredvidljivo klinično okolje. Podobno informacijo o prekrvavitvi si lahko prikažemo tudi pri dinamičnem slikanju PET z različnimi radiofarmaki. Obstajajo namreč radiofarmaki, ki se vežejo na patološke beljakovine, npr. amiloid beta pri Alzheimerjevi bolezni. Preden ta radiofarmak po žilju pripotuje do vseh delov možganov in »najde« vse plake, pa vseeno mine nekaj časa in v tem času lahko spremljamo sevanje, ki ga oddaja, ter pridobimo informacijo o prekrvavitvi. Izkaže se tudi, da je mirovna presnovna aktivnost možganov (pridobljena s slikanjem FDG PET) večinoma tesno povezana s karto možganskega krvnega pretoka. Tudi dinamično PET-slikanje je trenutno še vedno namenjeno raziskovalnemu okolju, saj je ob slikanju potrebna hkratna analiza arterijske krvi. V razvoju pa so tehnike, s katerimi bi lahko nadomestili arterijsko analizo krvi in to informacijo pridobili kar neposredno iz slike.
Kot alternativno metodo za prikaz mirovne aktivnosti možganov lahko uporabimo slikanje s funkcijsko magnetno resonanco v mirovanju (rs-fMRI). Tudi s to tehniko si prikažemo prekrvavitev možganov s spremljanjem razmerja oksi- in deoksihemoglobina. V preteklih letih je analitični napredek – ta metoda je namreč precej bolj občutljiva na šum kot npr. FDG PET in zato manj natančna – omogočil prepoznavo značilnih možganskih omrežij tudi iz slik rs-fMRI.
Na tem mestu bi rada še enkrat izpostavila, da pri raziskavah te vrste ne gre le za preučevanje posameznih elementov posnetkov možganov (vokslov ali regij), pridobljenih z različnimi slikovnimi modalitetami. Poudarek je predvsem na preučevanju odnosov med temi elementi, za kar se zanašamo na napredne matematične modele.
Opisane tehnike slikovne diagnostike na koncu dajo slikovne posnetke, ki jih z obdelavo podatkov po eni strani združujete v okviru posamičnega bolnika, po drugi strani pa pri skupinah bolnikov iščete značilnost posameznih bolezni in posameznih stadijev teh bolezni. Za katere bolezni je kompleksna analiza možganskih posnetkov predvsem pomembna?
Drži, po eni strani nam raziskave z uporabo slikovnih metod omogočajo vpogled v patofiziologijo bolezni na nivoju skupine (npr. pri modeliranju mrežnih sprememb), po drugi strani pa lahko določene spremembe izmerimo tudi na nivoju posameznega bolnika. Kompleksnejša analiza je dobrodošla predvsem pri tistih kliničnih stanjih in diferencialnodiagnostičnih dilemah, kjer prihaja do prekrivanja v klinični sliki kljub različni etiologiji in tudi zdravljenju, še posebej v začetnih fazah bolezni. To so npr. razlikovanje med Parkinsonovo boleznijo in drugimi, atipičnimi parkinsonizmi ter razlikovanja med različnimi tipi nevrodegenerativnih demenc. Izkaže se tudi, da lahko z napredno analizo prej zaznamo in bolj natančno opredelimo spremembe možganske aktivnosti kot pa le z vidnim pregledom slike FDG PET.
Katere funkcijske in patofiziološke značilnosti posamičnih možganskih bolezni je mogoče opazovati s kombinirano slikovno diagnostiko, ki ste jo opisali?
Uporabnih vrednosti take slikovne diagnostike je več. Kot je bilo že omenjeno, mnoge študije iz centrov po vsem svetu kažejo, da so pri različnih nevrodegenerativnih boleznih prisotni različni, značilni presnovni (presnovni zato, ker se je večina študij oprla na slikanje FDG PET) možganski vzorci. Izraženost posameznega vzorca nam lahko v prvi vrsti pomaga pri razlikovanju med boleznimi. Poleg tega lahko tako analizo uporabimo tudi za napoved napredovanja iz bolj zgodnjih bolezenskih stanj, kot je recimo blaga kognitivna motnja ali motnja faze spanja REM, v polno razvito bolezen, tj. demenco ali Parkinsonovo bolezen. Dobršen del članka smo posvetili tudi uporabni vrednosti pri sledenju učinka zdravljenja. Tukaj je večino raziskav narejenih na področju Parkinsonove bolezni, za katero imamo že vrsto let na voljo relativno učinkovita simptomatska zdravljenja – precej bolj učinkovita kot na področju demenc. Raziskave so pokazale, da se že simptomatsko zdravljenje, recimo z levodopo, odraža v nižji izraženosti parkinsonskih mrežnih sprememb. Pri kliničnih študijah z novimi zdravili, kot je npr. genetska terapija pri bolnikih s Parkinsonovo boleznijo, pa nam te napredne analize omogočijo vpogled v mrežne spremembe – nedavna študija je namreč pokazala, da se pri genetski terapiji vzpostavijo nove možganske povezave.
Kako izgleda patofiziologija in razvoj Parkinsonove bolezni skozi »pogled« vaših slikovnih preiskav in multiparametrskih analiz?
Parkinsonovo bolezen označuje več specifičnih presnovnih omrežij, ki odražajo posamezne značilnosti bolezni in so različno izražena v različnih fazah bolezni. V raziskavah opisujemo in opazujemo motorični in kognitivni vzorec Parkinsonove bolezni, ki korelirata z motoričnimi znaki oz. s stopnjo kognitivnega upada.
Motorični presnovni vzorec Parkinsonove bolezni je, zanimivo, izražen že pri bolnikih v prodromalni fazi. Patološke študije so pokazale, da se nevrodegenerativni proces v možganih, kopičenje patološkega proteina sinukleina alfa, začne že vrsto let preden se pojavijo simptomi. Dokazali smo tudi, da motoričnemu vzorcu Parkinsonove bolezni, po določenem časovnem zamiku, stereotipno sledi izraženost kognitivnega vzorca. Ti izsledki so skladni s stereotipnim sosledjem patoloških sprememb, ki jih je pred 20 leti opisal nevropatolog Braak, saj topografsko sovpadajo z njimi. V praksi to pomeni, da lahko in vivo opazujemo Braakovo zaporedje širjenja možganske prizadetosti.
Kateri del teh preiskav je že danes uporaben v redni klinični diagnostiki in kako poteka odločanje, katera slikanja uporabiti?
Na Kliniki za nuklearno medicino UKC Ljubljana za razlikovanje med različnimi nevrodegenerativnimi parkinsonizmi rutinsko uporabljamo slikanje FDG PET. Na preiskavo nevrologi napotimo bolnike v primeru nejasne klinične diagnoze. Natančna diagnoza ima namreč pomen tako pri načrtovanju zdravljenja, še posebej tistega z naprednejšimi metodami, kot pri prognozi. Slike rutinsko pregledujemo vizualno ter z uporabo enostavnih, t.i. univariatnih statističnih metod, kjer se vsak element slike primerja z referenčno skupino. V nejasnih primerih pa občasno uporabimo tudi napredne, multivariatne metode, opisane v članku, kjer se pri pacientu oceni izraženost enega ali več značilnih presnovnih možganskih vzorcev. Začenjamo tudi s projektom, s katerim bomo v redno klinično prakso vpeljali uporabo multivariatnih metod za analizo slik FDG PET možganov. Verjamemo, da se bodo dobro obnesle tudi v realnem kliničnem okolju, tako kot je to že pokazalo nekaj raziskav, in da bodo prispevale k dodatnemu izboljšanju diagnostične natančnosti s pomočjo slikanj FDG PET.
Kako po drugi strani izgleda razvoj in patofiziologija demenc?
Bolezenski proces pri kognitivnem upadu, katerega zadnja stopnja je demenca, se podobno kot pri Parkinsonovi bolezni začne že desetletja pred pojavom kliničnih simptomov. Tudi tukaj prihaja do nabiranja napačno zvitih beljakovin, recimo pri Alzheimerjevi bolezni amiloida beta in beljakovine tau. Raziskave kažejo tudi, da se obe beljakovini začneta kopičiti v topografsko omejenih predelih možganov ter se nato, kot prioni, razširita po možganih. Zanimivo je, da se patologija širi po funkcijsko povezanih delih možganov. Največ študij je narejenih na področju Alzheimerjeve bolezni, vendar se zdi, da je proces podoben, čeprav z drugimi glavnimi patološkimi krivci, tudi pri demenci z Lewyjevimi telesci in frontotemporalni demenci.
Kateri del teh preiskav je že danes uporaben v redni klinični diagnostiki in kako poteka odločanje, katera slikanja uporabiti?
Kot pri Parkinsonovi bolezni so tudi pri različnih nevrodegenerativnih demencah v možganih izraženi različni, a za sindrom značilni presnovni vzorci, katerih izraženost lahko preverimo pri vsakem bolniku. Tudi pri diagnostiki demenc se v klinični praksi pri nejasnih primerih zanašamo na slikanje FDG PET, podobno kot je zgoraj opisano pri diagnostiki parkinsonizmov. Sicer pa je, tako kot pri diagnozi parkinsonizmov, tudi pri demencah osnovno diagnostično orodje klinični nevrološki pregled. Sledijo laboratorijske in slikovne preiskave. Napotitev bolnika na slikanje FDG PET je nadgradnja osnovnega kliničnega pregleda. Pri bolniku s sumom na Alzheimerjevo bolezen lahko z analizo likvorja določimo tudi prisotnost amiloida beta in beljakovine tau. Obe beljakovini si lahko prikažemo tudi s slikanjem PET in radiofarmaki, ki se vežejo na amiloid beta ali beljakovino tau. Medtem ko je slikanje amiloida že v redni klinični praksi (v Sloveniji žal še ne), je slikanje beljakovine tau še vedno le v raziskovalni domeni.
Kaj lahko pomenijo kompleksne multiparametrske analize funkcijskih možganskih topografij pri klinični diagnostiki?
Pomenijo izboljšanje diagnostične natančnosti slikanja, kar ima veliko aplikacij. Danes v klinični praksi sicer žal še nimamo na voljo zdravil, ki bi vplivala na potek nevrodegenerativnih bolezni, kot je Alzheimerjeva bolezen, a so tako rekoč za vogalom. Z januarjem 2023 sta v Združenih državah Amerike odobreni že dve zdravili, ki se vežeta na plake amiloida beta, jih odstranjujeta iz možganov in upočasnjujeta napredovanje bolezni. Pričakuje se, da bosta letos odobreni tudi v Evropi. Poleg tega potekajo še mnoge raziskave na področju novih zdravil, tudi na naši kliniki. Bistvenega pomena za vključevanje ustreznih bolnikov v klinične študije pa je natančna diagnoza, h kateri, poleg likvorskih bioloških označevalcev, pomembno prispeva tudi analiza presnovnih možganskih omrežij. Diagnoza nevrodegenerativnih bolezni možganov, postavljena le na osnovi kliničnih znakov, je lahko napačna celo v tretjini primerov. Tako postajajo biološki označevalci, med njimi tudi slikovni, vedno pomembnejši.
Matej Perovnik, dr. med., je specializant nevrologije na Nevrološki kliniki, UKC Ljubljana. Med letoma 2018 in 2022 je delal kot mladi raziskovalec pod mentorstvom izr. prof. dr. Maje Trošt, dr. med., in prof. dr. Roberta Jeraja, univ. dipl. fiz., na KO za bolezni živčevja, Nevrološka klinika, UKC Ljubljana, in v interdisciplinarni raziskovalni skupini Medicinska fizika. Njegovo doktorsko raziskovalno delo je bilo posvečeno presnovnim slikovnim biološkim označevalcem pri nevrodegenerativnih demencah. Med doktoratom se je dodatno izobraževal na Univerzi v Bordeauxu, Francija, na KU Leuven, Belgija, in v Centru za nevroznanosti na Feinsteinovih inštitutih za medicinske raziskave v ZDA. Za svoje raziskovalno delo je bil nagrajen na mednarodni in nacionalni ravni: Junior Faculty Award na mednarodni konferenci Alzheimerjeve in Parkinsonove bolezni leta 2021, nagrada za najboljši raziskovalni prispevek na slovenskem nevrološkem kongresu leta 2022 in nagrada Melvina Yahra za mlade raziskovalce na svetovnem kongresu na temo Parkinsonove bolezni in podobnih motenj leta 2022. Je aktiven član Slovenskega društva za nevroznanost in od leta 2022 tudi tajnik društva.
Asist. Tomaž Rus, dr. med., je nevrolog, zaposlen na KO za bolezni živčevja, Nevrološka klinika, UKC Ljubljana. Na Kliniki za nuklearno medicino sodeluje pri rutinski funkcijski diagnostiki nevroloških bolezni. Njegovo klinično in raziskovalno delo je usmerjeno v nevrodegenerativne bolezni, tako motnje gibanja kot tudi kognitivne motnje. Njegovo doktorsko delo se osredotoča na presnovne biološke označevalce parkinsonizmov ter kognitivnih motenj s poudarkom na Creutzfeldt-Jakobovi bolezni. Za raziskovalno delo s tega področja je leta 2019 prejel nagrado Združenja nevrologov Slovenije za najboljši raziskovalni prispevek, leta 2020 je prejel mednarodno Medisovo nagrado za področje nevrologije ter v študijskem letu 2021/2022 kot doktorski študent Fulbrightovo štipendijo. Med specializacijo in doktorskim študijem se je dodatno izobraževal v Centru za nevroznanosti na Feinsteinovih inštitutih za medicinske raziskave v ZDA.
AVTOR: Prof. dr. Alojz Ihan, dr. med., Inštitut za mikrobiologijo in imunologijo, alojz.ihan@mf.uni-lj.si
Članek je bil objavljen v februarski reviji ISIS.
Članek je bil objavljen v reviji ISIS, februar 2023 Povezava >>>

