Jurij Hanžel je gastroenterolog, zaposlen na KO za gastroenterologijo UKC Ljubljana. Doktoriral je leta 2022, pod mentorstvom prof. Boruta Štabuca in somentorstvom prof. Geerta D'Haensa iz Amsterdama je preučeval povezavo serumskih koncentracij ustekinumaba in vedolizumaba z izidi zdravljenja kronične vnetne črevesne bolezni. Za doktorsko delo je prejel nagrado dr. Ane Mayer Kansky za odmevno doktorsko delo s področja biomedicine. Je avtor 57 člankov, indeksiranih v Pubmed.

AVTOR: Prof. dr. Alojz Ihan, dr. med., Inštitut za mikrobiologijo in imunologijo, alojz.ihan@mf.uni-lj.si
Članek je bil objavljen v reviji Isis povezava >>>
V junijski številki revije Drugs (IF 11,5) ste še s petimi sodelavci objavili pregledni članek o novih zdravilih za zdravljenje kronične vnetne črevesne bolezni (KVČB), ki tarčijo interlevkin 23 (IL-23). Pristop, ki se je že uveljavil pri zdravljenju luskavice, je pri zdravljenju KVČB še nekoliko v povojih?
Zdravila za imunsko posredovane bolezni preizkušajo za več indikacij, vrstni red pa običajno sledi njihovi prevalenci. Tako je skoraj pravilo, da bo novo zdravilo prej odobreno za luskavico ali revmatoidni artritis kot pa za KVČB. Tudi v državah z najvišjo prevalenco KVČB ta ne doseže 1 %, ki se nato še razdeli med Crohnovo bolezen in ulcerozni kolitis. S tržnega stališča je zato razumljivo, da KVČB ni prva indikacija za preizkušanje novega zdravila. Temu lahko dodamo še številne izzive, zaradi katerih klinične raziskave za paciente s KVČB niso nujno najbolj vabljiva izbira, in potrebo po rednih endoskopskih ocenah, kar tudi dodatno prispeva h kompleksnosti raziskav. Poleg ustekinumaba, zdravila, ki zavira IL-12 in IL-23 ter ga za zdravljenje KVČB uporabljamo že nekaj let, sta bila letos v Evropski uniji odobrena še dva selektivna zaviralca IL-23: mirikizumab za ulcerozni kolitis in risankizumab za Crohnovo bolezen. Klinične raziskave tretje faze za »manjkajočo« indikacijo potekajo pri obeh zdravilih.
Kako je prišlo do nastanka članka?
Med svojim izpopolnjevanjem v Amsterdamu sem začel sodelovati s kanadsko raziskovalno skupino, ki jo vodi profesor Brian Feagan z Univerze Western v Ontariu. V takšni ali drugačni vlogi je sodeloval pri preizkušanju velike večine zdravil za KVČB, odobrenih v zadnjih 20 letih, zato so ga povabili k pisanju preglednega članka o tej, za KVČB novi, skupini bioloških zdravil. Na podlagi dobrega sodelovanja v preteklosti in dejstva, da sem v delu svojega doktorata raziskoval uporabo zdravila ustekinumab pri Crohnovi bolezni, sem bil povabljen, da prispevam k delu preglednega članka.
Vemo, da je KVČB kompleksna in predvsem raznolika bolezen, pri iskanju dednih dejavnikov za njen nastanek je bilo najdenih prek 160 genov, ki večinoma služijo zagotavljanju barierne funkcije črevesne sluznice, uravnavanju protimikrobnega imunskega odziva, uravnavanju avtofagije in vnetja. Ob nepregledni kombinaciji dednih in okoljskih dejavnikov je verjetno vsak bolnik zgodba zase in tudi enaka terapija za vse ni realistična?
Izbira terapije je sedaj velik izziv. Dokler so bila na voljo le biološka zdravila iz razreda tumorje nekrotizirajočega dejavnika alfa (TNF-alfa), večjih dilem ni bilo. S prihodom novih bioloških zdravil, najprej zaviralca integrina α4β7, vedolizumaba, nato še zaviralcev IL-(12) ali -23 in nato še malih molekul, zaviralcev Janusovih kinaz, pa se je možnost izbire močno razširila, čemur pa zaenkrat še niso sledila spoznanja o tem, kako za posameznega pacienta izbrati optimalno zdravilo. Izbiro zdravila deloma narekuje fenotip bolezni: pri perianalnih fistulah je najučinkovitejši zaviralec TNF-alfa infliksimab, zaviralci TNF-alfa so učinkoviti tudi pri prizadetosti drugih organov v sklopu KVČB (sklepi, koža, oči). Upoštevamo tudi varnostni profil zdravil: zaviralci IL-23, IL-12/23 in vedolizumab so povezani z manjšim tveganjem za okužbe kot zaviralci TNF-alfa, zato ta zdravila pogosteje uporabljamo pri starejših bolnikih. Pričakovali bi, da zdravila izbiramo tudi glede na njihovo učinkovitost, vendar pa smo glede raziskav, ki bi med seboj primerjale različna biološka zdravila, močno omejeni – randomizirane raziskave, ki primerjajo dve zdravili, lahko preštejemo na prste ene roke. Do neke mere si lahko pomagamo z mrežnimi metaanalizami, ki med seboj primerjajo zdravila s sintezo randomiziranih raziskav, četudi zdravila niso bila neposredno primerjana med seboj znotraj iste raziskave. Izsledke teh metaanaliz moramo vrednotiti z nekaj zadržanosti, saj se moramo zavedati metodoloških omejitev tovrstnih primerjav. Tudi če zanemarimo metodološke pomisleke, pa takšne raziskave seveda ne morejo napovedati, ali se bo posamezen pacient na določeno zdravljenje odzval ali ne. Dodatno nerazrešeno vprašanje pa je, ali je pomemben vrstni red uporabe bioloških zdravil: je pri pacientu po odpovedi zdravljenja z zaviralci TNF najbolj smiselno uvesti zaviralec integrina, zaviralec IL-12/23 ali pa morda selektivni zaviralec IL-23.
Kakšne so smernice zdravljenja Crohnove bolezni in, posebej, glede vključevanja biološkega zdravljenja?
Zgodovinsko so se za indukcijo remisije pri Crohnovi bolezni uporabljali sistemski kortikosteroidi, za vzdrževanje remisije pa azatioprin, medtem ko aminosalicilati, ki jih s pridom uporabljamo pri ulceroznem kolitisu, za Crohnovo bolezen niso učinkoviti. Izid raziskav, na podlagi katerih so bila ta zdravila odobrena za uporabo, je bila klinična remisija, v grobem torej izboljšanje simptomov – driske in bolečin v trebuhu. Pri Crohnovi bolezni sta klinična in endoskopska aktivnost lahko v izrazitem neskladju, pacienti lahko navajajo razmeroma malo simptomov kljub endoskopsko močno aktivni bolezni, ravno endoskopska aktivnost bolezni pa je tista, ki je slab obet za zaplete bolezni. V praksi se je izkazalo, da z azatioprinom pogosto ni mogoče doseči zadovoljivega endoskopskega izboljšanja, zato se biološka zdravila v algoritem zdravljenja vključujejo bolj zgodaj, saj tako lažje in hitreje dosežemo cilje zdravljenja: klinično in endoskopsko remisijo. Uporaba azatioprina v monoterapiji za vzdrževanje remisije se tako močno zmanjšuje. Da bi se izognili neželenim učinkom kortikosteroidov, lahko pri določenih pacientih tudi za indukcijo remisije posežemo po bioloških zdravilih, prav tako po bioloških zdravilih posežemo pri določenih fenotipih bolezni, ki so močno povezani z agresivnim potekom bolezni in pojavom zapletov (perianalne fistule, notranje fistule, obsežna prizadetost tankega črevesa, veliko vnetno breme, ulcerozni pankolitis s povišanim CRP). Podlaga za uvedbo bioloških zdravil za KVČB v Sloveniji je sklep konzilija za KVČB enega od obeh univerzitetnih kliničnih centrov.
Opozoril bi še na zanimivo spoznanje iz zadnjih let. Kirurgija je bila vedno del multidisciplinarnega zdravljenja KVČB, neredko uporabljena kot izhod v sili, ko so zdravila odpovedala. Vse bolj se zdi, tako na podlagi randomiziranih kot populacijskih opazovalnih raziskav, da je lahko zgodnja ileocekalna resekcija pri pacientih s Crohnovo boleznijo, omejeno na krajši odsek terminalnega ileuma brez stenoz, dobra alternativa medikamentnemu zdravljenju.
Zakaj se zdi, da je tarčenje IL-23 velik obet za dobro kontrolo bolnikov s KVČB?
Kot je bilo omenjeno v enem od prejšnjih vprašanj in obširneje razloženo v nedavnem intervjuju s prof. Potočnikom, je znanih vse več genov, povezanih s pojavom KVČB. Med njimi je najbolj znan gen NOD2, saj najbolj poveča tveganje za pojav KVČB v primerjavi z ljudmi, ki mutacije v tem genu nimajo. Mutacije v genu IL23R, ki kodira receptor za IL-23, pa so po povečanju tveganja na drugem mestu. Ta spoznanja kažejo na pomembno vlogo tega citokina v patogenezi KVČB. Dober obet seveda predstavljajo tudi pozitivne klinične raziskave tretje faze, ki so bile podlaga za odobritev mirikizumaba za ulcerozni kolitis in risankizumaba za Crohnovo bolezen, slednje zdravilo je tudi v postopku odobritve za ulcerozni kolitis.
Kakšna je vloga IL-23 pri patogenezi KVČB?
Citokin IL-23 je sestavljen iz dveh podenot: p19 in p40, slednjo si deli z IL-12. Njegovi selektivni zaviralci (risankizumab, mirikizumab, guselkumab, brazikumab) se vežejo na p19, neselektivni (ustekinumab) pa na p40, ti zato zavirajo tudi IL-12. IL-23 izločajo dendritične celice in makrofagi. Pomembno vpliva tako na mehanizme prirojene imunosti kot mehanizme, posredovane z limfociti T. Posredno spodbuja diferenciacijo celic T pomagalk v smer TH17, ki nato izločajo IL-17, IL-22 in TNF-alfa. Pomen te signalne poti za spodbujanje vnetja pri KVČB so potrdile raziskave na živalskih modelih in raziskave genetskih polimorfizmov pri ljudeh. Zanimivo lekcijo o nepredvidljivosti citokinske biologije je ponudil neuspeh inhibicije IL-17 pri Crohnovi bolezni. Zdravila, učinkovita za luskavico, namreč niso bila le neučinkovita, temveč so celo poslabšala Crohnovo bolezen. K neuspehu je deloma prispevalo dejstvo, da IL-17, med drugim, izboljšuje barierno funkcijo črevesne sluznice, vsi mehanizmi tega terapevtskega neuspeha pa še niso pojasnjeni.
Katera zdravila, usmerjena v tarčenje IL-23, največ obetajo pri zdravljenju KVČB?
Pravega odgovora na to vprašanje nimam, saj v registracijskih raziskavah zdravila primerjajo s placebom, kar nam ne pove veliko o njihovi učinkovitosti v primerjavi z drugimi zdravili. Zaradi možnih razlik med preučevanimi pacienti odstotkov remisije ne moremo slepo primerjati med različnimi raziskavami in tako sklepati, kako bi se dve zdravili odrezali v neposredni primerjavi. S tega stališča so izredno zanimivi izsledki raziskave SEQUENCE, ki so bili predstavljeni oktobra. Paciente s Crohnovo boleznijo po odpovedi zaviralcev TNF-alfa so randomizirali v skupino, zdravljeno z risankizumabom, selektivnem zaviralcem IL-23, in skupino, zdravljeno z ustekinumabom, zaviralcem IL-12 in IL-23. Odstotek remisije je bil pomembno višji v skupini, zdravljeni z risankizumabom, presenetljiva je bila predvsem velikost razlike: 19 odstotnih točk za klinično remisijo in 16 odstotnih točk za endoskopsko remisijo, kar je za dve zdravili, ki sta obe učinkovitejši od placeba, osupljivo veliko. Raziskava je odgovorila na del vprašanj o razlikah med izoliranim zaviranjem IL-23 in kombiniranim zaviranjem IL-12 in IL-23, v prihodnje pa se bomo ukvarjali z vprašanjem, ali je po odpovedi enega zaviralca IL-23 smiselno poseči po naslednjem ali ne.
Kako je z varnostjo in neželenimi učinki zdravil, ki delujejo na IL-23?
Ugoden varnostni profil zaviralcev IL-23 je njihova pomembna prednost. V doslej opravljenih raziskavah, tako pri luskavici kot pri KVČB, niso ugotavljali morebitnega povečanega tveganja za pojav resnih okužb, malignih bolezni ali srčno-žilnih dogodkov. Seveda pa tudi velike klinične raziskave tretje faze ne morejo izluščiti redkih neželenih učinkov, ki so lahko klinično še kako pomembni. Tako je bilo z reaktivacijo latentne tuberkuloze pri zdravljenju z zaviralci TNF-alfa. Povezave niso ugotovili v registracijskih študijah, ampak z analizo farmakovigilančnih podatkov po približno treh letih klinične uporabe. Za trdnejše podatke o varnosti zaviralcev IL-23 bomo torej morali počakati še nekaj let, trenutno pa se zdi, da ni razlogov za skrb. Ustekinumab, zaviralec IL-12/23, pa je v klinični uporabi že dlje časa in ni se izkazalo, da bi bila njegova uporaba povezana s pomembnejšimi neželenimi učinki.
Če določeno biološko zdravilo ne deluje, kaj so glavni vzroki? In kaj, če deluje in njegovo delovanje sčasoma preneha?
Zaviralci TNF-alfa so razmeroma bolj imunogeni kot novejša biološka zdravila, kar pomeni, da pri bolnikih, zdravljenih s temi zdravili, obstaja večja verjetnost za pojav protiteles proti zdravilu, ki zmanjšujejo njegovo učinkovitost. Pri bolnikih, ki se niso odzvali na zdravljenje s temi biološkimi zdravili ali pa so sčasoma izgubili odziv, se je zato uveljavilo merjenje koncentracij zdravila in titra protiteles, usmerjenih proti zdravilu. Na podlagi rezultatov teh meritev lahko opredelimo vzroke za nedelovanje zdravila. Če je koncentracija zdravila ustrezna, protiteles proti zdravilu pa ni zaznati, gre za farmakodinamsko odpoved zdravila: njegov mehanizem delovanja ne ustreza prevladujočemu patogenetskemu mehanizmu pri danem pacientu, treba je poseči po zdravilu z drugačnim mehanizmom delovanja. O farmakokinetski odpovedi zdravila govorimo, kadar so njegove koncentracije nizke in/ali so prisotna protitelesa, usmerjena proti zdravilu. V teh primerih je včasih še mogoče ponovno doseči učinkovanje zdravila z dvigom odmerka in/ali dodatkom azatioprina, ki prispeva k izginotju protiteles, usmerjenih proti zdravilu.
Biološka zdravila, ki so bila registrirana po zaviralcih TNF-alfa, so manj imunogena, zato nanje ne moremo preslikati zgoraj navedenih načel. Opredelitev farmakodinamske odpovedi je prav tako šele v povojih. Eksperimentalni podatki sicer kažejo, da se pri bolnikih, ki se ne odzivajo na zdravljenje z zaviralci TNF-alfa, poviša izražanje IL-23 v črevesni sluznici, kar daje slutiti, da bi bilo za te paciente primerno naslednje zdravilo monoklonsko protitelo, usmerjeno proti temu citokinu, vendar prospektivnih raziskav, kjer bi naslednje zdravilo izbirali glede na molekularni profil sluzničnih biopsij, še ni.
Na začetku dobe bioloških zdravil se je biološko zdravljenje kroničnih vnetnih bolezni začenjalo razmeroma pozno, ko si je bolnik s težavami in z neodzivnostjo na druga zdravila »prislužil« zdravljenje, zdaj so trendi na vseh področjih drugačni?
Res je, posebno pri Crohnovi bolezni, ki prizadene vse sloje stene prebavil, je zgodnje zdravljenje pomembno, saj z dolgotrajnim neobvladanim vnetjem pride do strukturnih sprememb prebavil z razvojem fibroze in zožitev, česar zdravila niso več zmožna razrešiti. Verjetnost za remisijo pri kratkotrajni Crohnovi bolezni je pomembno višja kot pri dlje trajajoči bolezni, medtem ko pri ulceroznem kolitisu razlika ni tako prepričljiva. V nedavni raziskavi registra slovenskih pacientov s KVČB se je izkazalo, da je v zadnjih letih povprečni čas od diagnoze do uvedbe biološkega zdravila res zelo kratek, v povprečju okrog pet mesecev. Tveganje za kirurško resekcijo v zadnjem desetletju prepričljivo upada, tako pri ulceroznem kolitisu kot pri Crohnovi bolezni, metodološko pa je težko razločiti, ali gre za izoliran vpliv zgodnejšega zdravljenja z biološkimi zdravili ali pa za več sprememb v celostni obravnavi bolezni. Pri pomislekih o varnosti bioloških zdravil, ki so bili v preteklosti včasih zadržek za njihovo uvajanje, moramo imeti pred očmi alternativo – aktivno bolezen in dolgotrajno izpostavljenost kortikosteroidom. Ravno ta dva dejavnika pa sta najmočneje povezana s tveganjem za resne okužbe in druge zaplete bolezni, bolj kot katero koli biološko zdravilo.
Ko govorimo o personalizirani medicini in zlasti zdravljenju, se znotraj tega popularnega izraza skriva stotine različnih diagnostičnih in terapevtskih idej, od zgolj potencialnih do že uveljavljenih v vsakdanji rutini. Kako je personalizacija urejena pri zdravljenju KVČB že zdaj in kaj so možnosti?
Izraz personalizirana medicina v sebi zares skriva marsikaj. V zelo širokem pomenu izraza je personalizacija tudi uvajanje zdravil glede na fenotip bolezni (zaviralci TNF-alfa za perianalno Crohnovo bolezen), značilnosti pacienta (uvedba biološkega zdravila z manjšim tveganjem za pojav okužb pri starejšem pacientu) in želje pacienta (peroralno, intravensko ali subkutano odmerjanje). Dodaten vidik personalizacije je tudi individualizirano odmerjanje bioloških zdravil glede na meritve serumskih koncentracij, saj se je izkazalo, da odobreni režim odmerjanja pri nekaterih pacientih enostavno ne zadostuje za učinkovit nadzor nad boleznijo. Do personalizirane medicine v ožjem smislu, kjer bi na podlagi označevalcev lahko racionalno izbrali učinkovito zdravilo za posameznega pacienta, pa bo preteklo še nekaj časa. V Veliki Britaniji so ravno zaključili z raziskavo PROFILE, v kateri so paciente z novoodkrito Crohnovo boleznijo na podlagi transkripcijskega profila limfocitov T razdelili v skupino z visokim tveganjem za zaplete in skupino z nizkim tveganjem za zaplete, nato pa te paciente naključno dodelili terapevtskemu algoritmu z bolj intenzivnim ali manj intenzivnim zdravljenjem. Rezultate nestrpno pričakujemo. Eden od pristopov k personalizaciji pa vključuje analizo epigenetskih označevalcev, ki bi lahko usmerjali izbiro terapije. Leta 2024 se začenja randomizirana raziskava OMICROHN, ki bo primerjala standardni način z empirično izbiro biološke terapije in način, ki bo temeljil na epigenetskih označevalcih. V raziskavi bo sodeloval tudi naš oddelek.
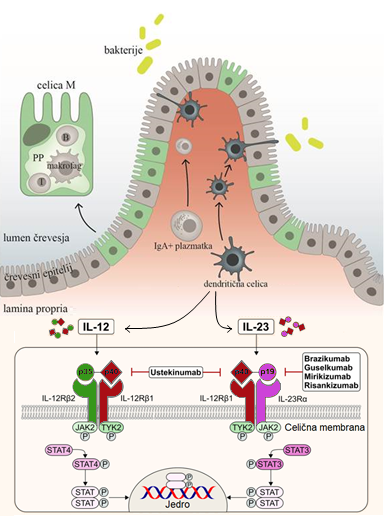
Citokina interlevkin (IL)-12 in -23 izločajo dendritične celice in makrofagi. Njuna receptorja sta deloma sorodna, saj si delita podenoto p40. Z vezavo na svoje receptorje spodbudita sintezo številnih citokinov, pomembnih v patogenezi kronične vnetne črevesne bolezni. Inhibicija IL-23 z vezavo monoklonskih protiteles na podenoto p19 oziroma inhibicija obeh citokinov z vezavo na podenoto p40 se je izkazala za učinkovito prijemališče v zdravljenju kronične vnetne črevesne bolezni. Za klinično rabo so trenutno odobrena zdravila ustekinumab, risankizumab in mirikizumab, druga so še v preizkušanju.
Na KO za gastroenterologijo UKC Ljubljana izvajamo diagnostiko, zdravljenje in rehabilitacijo bolnikov z boleznimi prebavil, dodiplomsko in podiplomsko izobraževanje zdravnikov in medicinskih sester ter raziskave. Konzilij za kronično vnetno črevesno bolezen obravnava bolnike iz vse Slovenije. Vključeni smo v multicentrične mednarodne raziskave s področja endoskopije, kronične vnetne črevesne bolezni, hepatologije in gastroonkologije. V okviru terciarne dejavnosti izvajamo še radiofrekvenčno ablacijo Barrettovega požiralnika, endoskopsko submukozno disekcijo, enteroskopijo, biopsije z endoskopskim ultrazvokom, funkcionalno diagnostiko prebavil ter vodenje pacientov pred in po presaditvi jeter. V Sloveniji opravimo večino ERCP-posegov (ERCP – endoskopska retrogradna holangiopankreatografija), endoskopskih submukoznih disekcij predrakavih in rakavih sprememb prebavne cevi ter zahtevnejših endoskopskih posegov.


